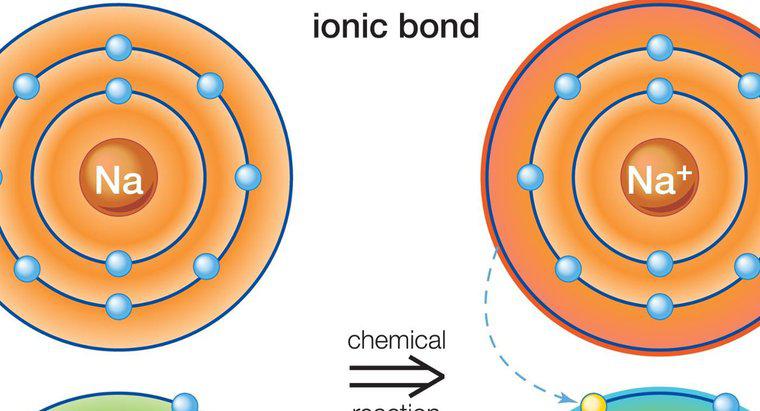
Los compuestos iónicos contienen átomos y moléculas con cargas opuestas. Se unen entre sí como resultado de sus cargas opuestas. Por ejemplo, un enlace iónico emparejado negativamente con un ion positivo. Los átomos y las moléculas con cargas similares se repelen entre sí. Las moléculas con una carga positiva se llaman cationes, y las moléculas con una carga negativa se llaman aniones.
Compuestos iónicos
Los compuestos iónicos se forman como resultado de átomos o moléculas que atraen más átomos o moléculas con una carga opuesta. La composición varía según el tipo de compuesto, pero todos los compuestos iónicos deben tener una carga eléctrica neutra. Eso significa que deben tener una proporción igual de moléculas aniónicas y catiónicas.
Los compuestos iónicos son típicamente sólidos. Pueden estar hechos de átomos individuales, llamados compuestos monoatómicos, o de múltiples átomos, lo que los hace compuestos poliatómicos. La unión iónica, que forma moléculas iónicas, implica la transferencia de electrones de metales a no metales. Los metales tienden a perder electrones positivos fácilmente porque tienen pocos electrones en su nivel de energía externa. Los no metales tienen más electrones negativos en su nivel de energía exterior. Buscan iones positivos como resultado, y naturalmente se unen con moléculas metálicas. La mayoría de los compuestos poliatómicos son aniónicos, con la excepción del catión amonio. Los compuestos iónicos difieren de los compuestos moleculares en que pueden formarse a partir de metales y no metales, mientras que los compuestos moleculares solo pueden formarse a partir de no metales. Los tipos comunes de compuestos iónicos son la sal y el azúcar.
Compuestos moleculares
Los compuestos moleculares, también llamados compuestos covalentes, comparten electrones formando enlaces covalentes. Mientras que los compuestos iónicos pueden consistir en átomos y moléculas metálicos y no metálicos, los enlaces covalentes solo pueden formarse a partir de átomos y moléculas no metálicos. Un compuesto covalente se forma cuando los átomos dentro de diferentes elementos se combinan a través de moléculas. Esta unión permite compartir electrones de valencia, lo que crea una atracción común que mantiene unidos a los átomos en la molécula.
Los compuestos covalentes varían considerablemente en tamaño. Algunos son pequeños, con solo algunos elementos, mientras que otros pueden tener miles de átomos. Debido a que comparten electrones en lugar de intercambiarlos, los compuestos covalentes tienen propiedades considerablemente diferentes que los compuestos iónicos. Los compuestos covalentes tienden a quemarse fácilmente, mientras que los compuestos iónicos no lo hacen. En contraste con los compuestos iónicos, no son solubles en agua. Otra distinción entre los dos tipos de moléculas es que los compuestos covalentes no pueden conducir la electricidad, pero los compuestos iónicos generalmente pueden. A temperatura ambiente, la mayoría de los compuestos covalentes están en forma líquida o gaseosa en lugar de aparecer como sólidos. Esto se debe al hecho de que sus moléculas individuales se separan más fácilmente que las moléculas en un cristal, lo que les da un punto de ebullición relativamente bajo. Los compuestos moleculares simples tienen la misma estructura de nombre. Se encuentran en la tabla periódica al nombrar primero el elemento que aparece más a la izquierda de la tabla, luego agregar "ide" al segundo elemento nombrado y usar prefijos para identificar el número de átomos en cada elemento. Las proteínas y los carbohidratos son dos ejemplos de compuestos moleculares. Otros compuestos moleculares incluyen gas metano, óxido de nitrógeno y cloruro de sodio.