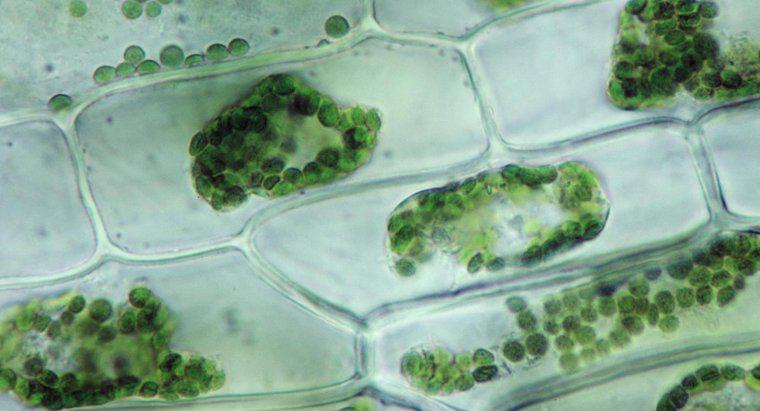
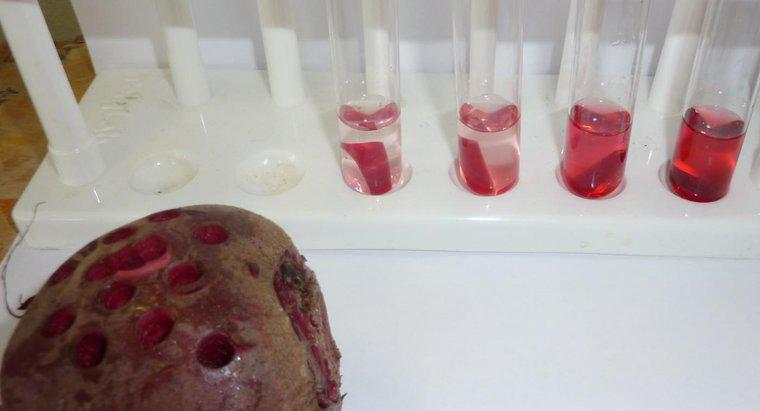
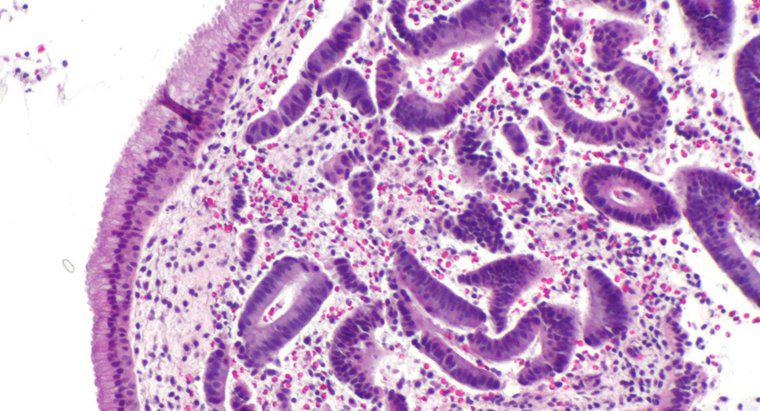
La ósmosis es un tipo particular de difusión en el que el agua cruza una membrana semipermeable hacia un área con una mayor concentración de solutos, mientras que la difusión estándar a menudo permite el movimiento libre de ambos solutos y el disolvente hacia el equilibrio. > La difusión en general es el movimiento neto de moléculas en solución desde áreas de mayor concentración a áreas de menor concentración. La presión osmótica es potencialmente muy poderosa, y la presión osmótica es la única fuerza necesaria para mover el agua desde las raíces hasta las copas de los árboles más altos del mundo.
Cuando el agua disuelve otra sustancia, se debe a que las moléculas de agua polares y el soluto se atraen entre sí. Cada átomo, ion o molécula de soluto tiene una carga en al menos una región que atrae a un lado u otro de la molécula de agua. Como tal, tantas moléculas de agua como sea posible tienden a reunirse alrededor de cada partícula de disolvente. En el agua líquida, todas las moléculas están en constante movimiento aleatorio alrededor de la otra. Sin embargo, debido a la atracción, las moléculas de agua son ligeramente más propensas a moverse hacia las partículas de soluto que las que están lejos de ellas, y las partículas de soluto son más propensas a moverse hacia las moléculas de agua que otras partículas de disolvente. Este movimiento neto resulta, gradualmente, en una distribución uniforme del soluto. En la ósmosis, solo las moléculas de agua pueden moverse para igualar las concentraciones.