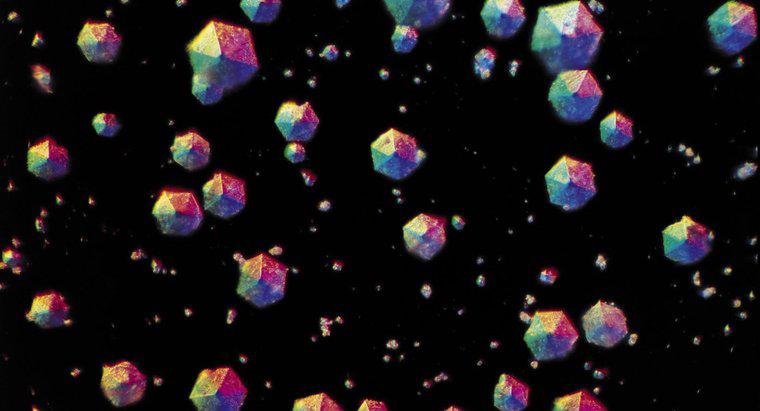La cristalización separa un sólido disuelto en un líquido que ha formado una solución. Para cristalizar el sólido, la solución se calienta en un recipiente abierto para permitir que el líquido se evapore, dejando atrás el sólido cristalino.
La cristalización puede ser natural o artificialmente inducida. Además de los cristales que precipitan de una solución líquida, la cristalización también puede ocurrir en un líquido fundido que se enfría o un gas que se deposita en una superficie. La cristalización se produce en dos pasos principales: nucleación y crecimiento de cristales.
Durante la fase de nucleación, las moléculas de disolvente dispersadas en la solución se atraen entre sí, formando grupos de tamaño nanométrico. Detener el proceso en esta etapa y estabilizar los nanoclusters es una técnica comúnmente utilizada en la síntesis de nanopartículas. Si se deja que el proceso continúe, se obtienen núcleos estables que persisten sin disolverse en la solución. El tamaño crítico que estos núcleos deben alcanzar para estabilizarse depende de las condiciones del sistema, como la temperatura de la solución y la concentración de solvente.
La etapa de crecimiento del cristal implica la posterior atracción de moléculas de solventes adicionales a los núcleos que previamente han logrado alcanzar un tamaño crítico. Este proceso continúa mientras la solución esté supersaturada: se disuelve más solvente de lo que puede soportar en estas condiciones particulares.