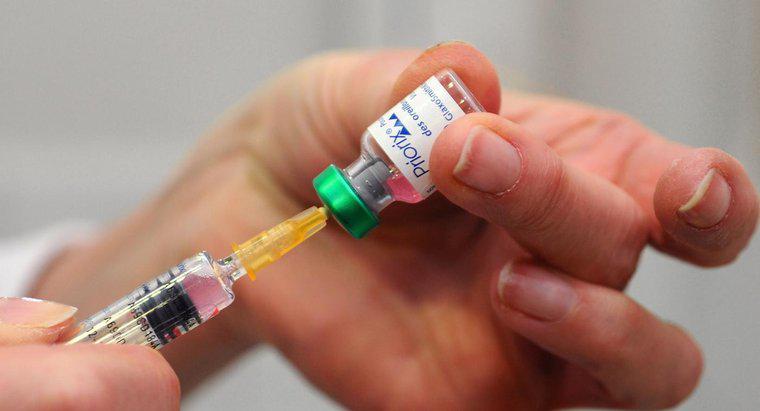
Una aplicación práctica de la ley de Boyle es extraer fluido en una jeringa. Al tirar hacia atrás del émbolo, aumenta el volumen interior de la jeringa y reduce su presión. El líquido que se encuentra en el exterior de la jeringa se succiona en el cilindro hasta que la presión interior y exterior se equilibran.
La ley de Boyle establece que el volumen y la presión de un gas o líquido permanecen constantes siempre que la temperatura de la sustancia permanezca igual. Esta ley, que fue declarada por primera vez por Robert Boyle en el siglo XVII, es de vital importancia en aplicaciones de ingeniería como el diseño de motores. Su fórmula es V1 /V2 = P2 /P1 (a temperatura constante), donde V1 es el volumen inicial, V2 es el volumen modificado, P1 es la presión inicial y P2 es la presión modificada.
La ley más estrechamente relacionada con la ley de Boyle es la ley de Charles, o la "ley de los volúmenes", que es obra del científico francés Jacques Charles. Describe la relación entre volumen y temperatura. Tanto la ley de Boyle como la ley de Charles son teorías del gas que describen el comportamiento de un hipotético gas "ideal". En la práctica, sin embargo, ambos también se aplican a líquidos. La ley de Boyle a veces se llama ley de Mariotte, una referencia al investigador francés que descubrió los mismos principios 14 años después de la publicación de Boyle. Esta convención de nomenclatura es popular en Francia y otras naciones europeas.