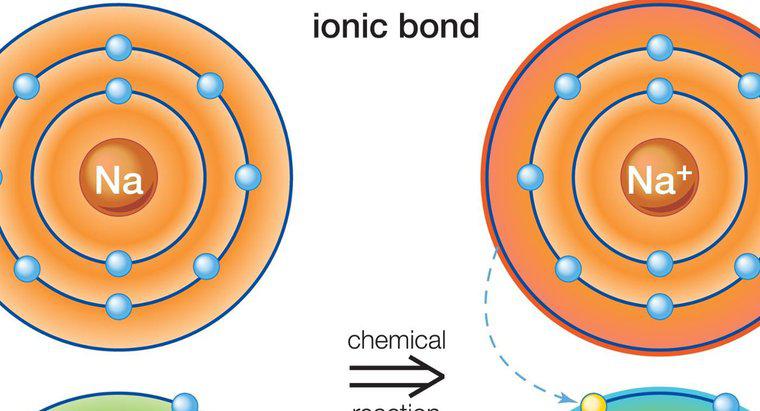
Los átomos involucrados en el enlace iónico se mantienen unidos por una fuerza de atracción electrostática entre un ion positivo y un negativo. Los enlaces iónicos solo se forman entre metales y no metales.
La unión iónica se produce en presencia de un ion positivo y un negativo. Los iones se forman cuando los átomos neutros pierden o ganan un electrón. Todos los átomos pierden o ganan electrones para lograr una configuración electrónica estable. Los gases nobles más estables, todos tienen ocho electrones en sus capas más externas, con la excepción del helio, que tiene solo dos electrones. Cuando un átomo tiene ocho electrones en su capa externa, se dice que tiene una estructura de octetos estable.
Los metales tienen uno a tres electrones en sus capas externas, lo que les impide formar una estructura estable de octetos. Es más fácil para los átomos perder electrones para revelar una capa subyacente con ocho electrones, en lugar de ganar electrones para completar la estructura del octeto. Por lo tanto, los metales forman iones positivos. Sin embargo, los no metales tienden a ganar uno o más electrones para completar el octeto en su capa más externa y, por lo tanto, tienden a formar iones negativos.
Los metales pueden donar sus electrones a no metales. Dado que las cargas en los iones son diferentes (iones cargados opuestamente), el átomo de metal cargado positivamente se mantiene en el átomo no metálico cargado negativamente con una fuerza de atracción electrostática fuerte.