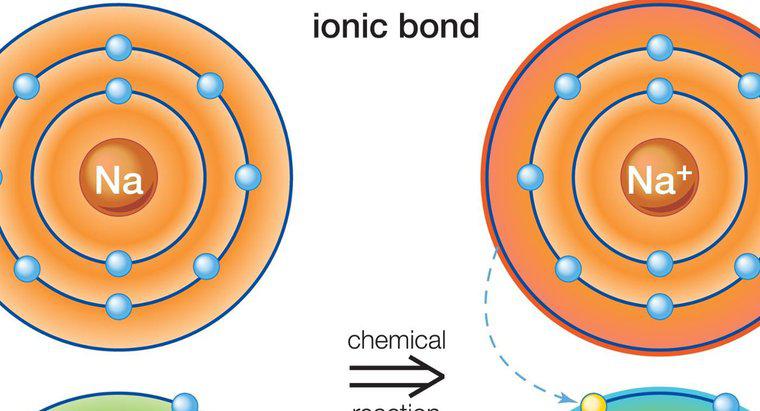
Las soluciones acuosas de compuestos iónicos son buenos conductores de electricidad, mientras que las soluciones de compuestos moleculares no lo son. Esto es cierto porque los iones individuales en los compuestos iónicos pueden disociarse completamente en el agua y las moléculas permanecen completas. Los compuestos iónicos y moleculares también afectan los puntos de ebullición y fusión del agua.
Los compuestos iónicos se disuelven más fácilmente en el agua que los compuestos moleculares, aunque hay excepciones a esta regla. El agua se utiliza como estándar para determinar la solubilidad de un compuesto porque es altamente polar y puede disolver más compuestos que cualquier otro disolvente, lo que le da el título del disolvente universal. Los compuestos iónicos conducen la electricidad cuando se disocian porque facilitan la transferencia de electrones. La diferencia en las cargas de las partículas permite que los electrones libres salten de una partícula a otra fácilmente. Las moléculas comparten sus electrones y tienen una carga neutra general que no permite mucha conductividad.
Los compuestos iónicos tienen altos puntos de fusión y ebullición, mientras que los compuestos moleculares tienen puntos de fusión y ebullición relativamente bajos. Estas propiedades se transfieren al agua cuando los compuestos se disuelven en ella. Los compuestos iónicos disociados elevan el punto de fusión y disminuyen el punto de congelación del agua. Los compuestos moleculares generalmente tienen el efecto opuesto si se disuelven en agua.