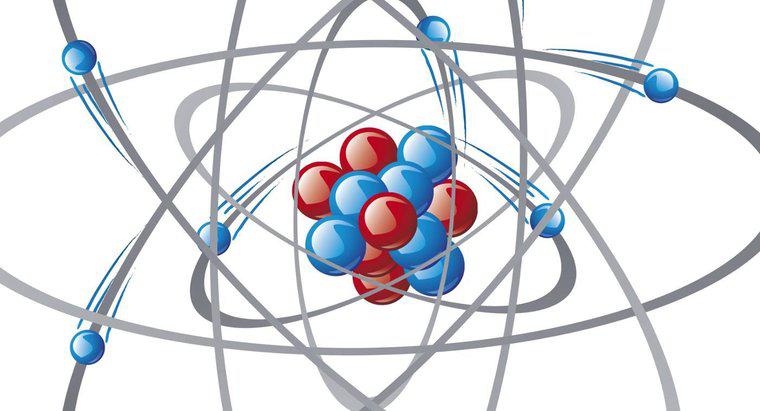
Un catión se forma cuando un átomo pierde electrones. Un átomo que pierde electrones pierde carga negativa; por lo tanto, se vuelve cargado positivamente. Estos átomos tienen una baja afinidad o atracción por los electrones y se denominan átomos electropositivos.
De acuerdo con la regla del octeto, los átomos buscan ganar o perder electrones para lograr ocho electrones en sus niveles de energía más externos, que es el número máximo permitido de electrones en estas capas de energía y la forma más estable de un átomo. Los elementos de la tabla periódica que tienen el número máximo de electrones en sus niveles de energía más externos son los gases nobles. Estos elementos son los más estables de todos, y son reacios a formar compuestos con otros. Todos los demás elementos desean imitar los gases nobles en términos de configuración electrónica.
Los átomos que tienen pocos electrones en sus niveles de energía externos tienden a perder electrones frente a otros átomos. Los elementos con mayor probabilidad de convertirse en cationes son los de los grupos de metales alcalinos y alcalinotérreos de la tabla periódica, porque son los elementos más electropositivos.
Los electrones perdidos por los cationes son recogidos por elementos fuertemente electronegativos, que se encuentran en el lado derecho de la tabla periódica. Los átomos que captan electrones para volverse más estables se llaman aniones. Como las cargas opuestas se atraen, los cationes y los aniones típicamente forman enlaces, convirtiéndose así en compuestos neutros. La formación de enlaces entre cationes y aniones se denomina enlace iónico, y estos compuestos se denominan compuestos iónicos.