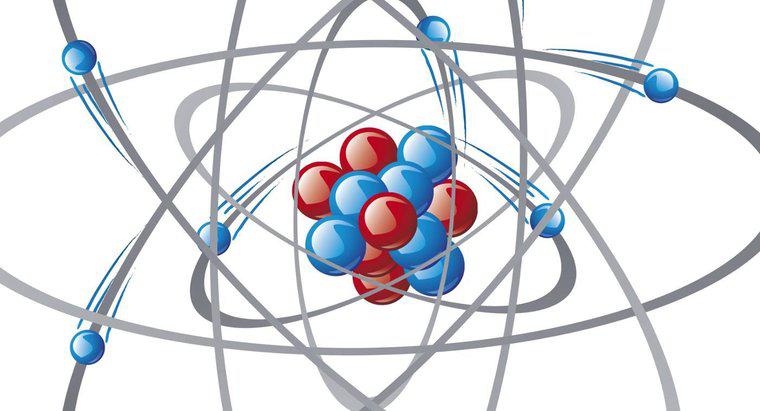
Aunque cada átomo está formado por partículas de diferentes tamaños, la mayor parte del espacio o volumen de cada átomo consiste en su nube electrónica. Sin embargo, entre las tres moléculas presentes, los neutrones son las más grandes y el núcleo del átomo constituye el 99.9 por ciento de su masa total.
La estructura básica de cualquier átomo incluye un núcleo hecho de protones y neutrones y una serie de pequeños electrones que orbitan alrededor de él en un espacio llamado nube de electrones. La única excepción a esta estructura es el átomo de hidrógeno, que no contiene neutrones.
Los átomos, al igual que las partículas que forman, contienen más espacio vacío que masa, ya que la carga positiva de los protones y la carga negativa de los electrones se repelen entre sí. Esto crea lo que los científicos denominan una "nube de electrones" que rodea el núcleo de cada átomo. En términos de volumen, la nube de electrones constituye la mayoría del "espacio" de cada átomo. Una ilustración común de este espacio indica que si el núcleo de un átomo fuera del tamaño de una canica, entonces el borde exterior de la nube electrónica estaría a más de 100 yardas, o un campo de fútbol, lejos de ella.
Sin embargo, a pesar del hecho de que la mayoría del espacio de cada átomo contiene sus electrones, la mayor parte de su masa, el 99.9 por ciento, se encuentra en el núcleo. La masa del núcleo de un átomo se divide casi uniformemente entre los protones y los neutrones, aunque los neutrones son un poco más grandes. La masa de un electrón, por el contrario, es igual a 1/1836 de un protón.