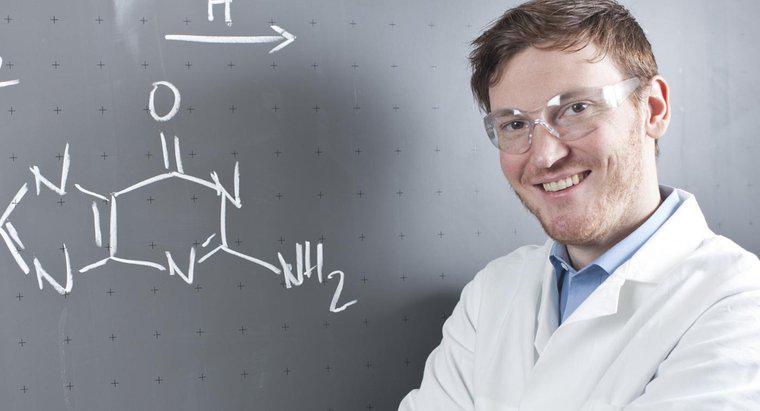
Las ecuaciones químicas siempre deben equilibrarse debido a los principios descritos en La Ley de Conservación de la Materia. Esta ley científica establece que la materia no puede crearse de la nada ni puede ser destruida. Por lo tanto, la misma cantidad de materia, en forma de átomos, debe existir antes y después de la reacción química. El asunto puede cambiar de forma o ubicación, pero no puede desaparecer por completo o aparecer de la nada.
A veces es más fácil imaginar los átomos que forman una ecuación química como algo más grande. Por ejemplo, si uno está haciendo una ensalada, puede comenzar con una lechuga, un tomate entero y una zanahoria. Necesita cortar estas verduras para hacer la ensalada, pero en realidad no ha hecho desaparecer algunas de las verduras solo porque las cortó en trozos más pequeños. No se han creado nuevos vegetales, los componentes de la ensalada acaban de mezclarse. Lo mismo ocurre con las ecuaciones químicas que comienzan con una cierta cantidad de un elemento y terminan con la misma cantidad, en el nivel atómico, de otro.
Una de las ecuaciones químicas más simples es H2 + O2 - & gt; H2O. Es decir, dos átomos de hidrógeno y un átomo de oxígeno se combinan para formar una sola molécula de agua.