Cuando dos o más elementos químicos diferentes se combinan, forman un compuesto. La forma en que esos átomos se combinan o se unen depende del elemento y sus características. El enlace que mantiene unidos a los átomos determina el tipo de compuesto que es, y estos pueden ser iónicos o covalentes.
Principios básicos de la vinculación Los átomos se clasifican y se caracterizan por el número de electrones que contienen. Cada elemento tiene un número diferente de electrones alojados en los orbitales que rodean el núcleo. El orbital externo se conoce como el orbital de valencia, y estos electrones son los que se utilizan en el proceso de unión. Cada átomo busca tener un orbital externo completo de electrones para ser estable. Para la mayoría de los átomos, este orbital externo contiene ocho electrones. La regla del octeto se refiere al requisito de los electrones para ganar, perder o compartir electrones para llenar el orbital externo. Cuando los átomos ganan o donan electrones a otro elemento, forman compuestos iónicos. Cuando los átomos comparten electrones con otro elemento, forman compuestos covalentes.
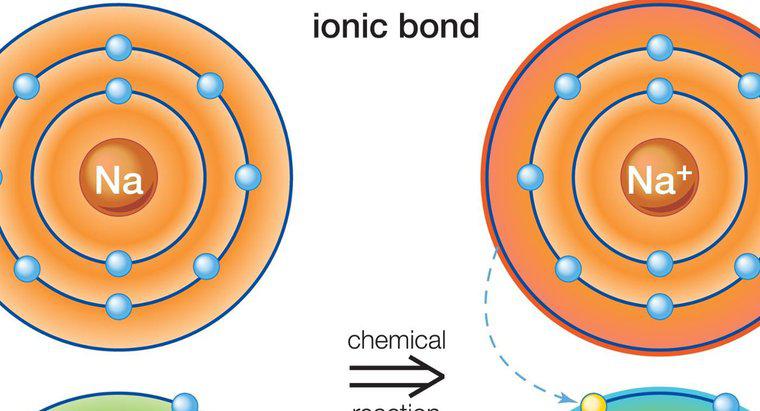
Compuestos iónicos
Los compuestos iónicos se forman entre metales y no metales. Los metales típicamente tienen pocos electrones de valencia en el orbital externo, mientras que los no metales tienen muchos. El metal actúa como un donante y transfiere sus electrones de valencia al no metal, satisfaciendo así la regla del octeto necesaria para formar un átomo estable. Esto da como resultado un átomo metálico cargado positivamente y un átomo no metálico cargado negativamente, conocido como iones. Debido a las cargas opuestas, los dos iones se atraen entre sí y permanecen juntos, formando así un compuesto iónico. Más de un electrón puede ser transferido en este proceso. Debido a que los átomos cargados flotan libremente, se sienten atraídos por otros átomos con la carga opuesta, no solo por el átomo del que donaron o recibieron los electrones.
Las características de los compuestos iónicos son que son sólidos cristalinos con altos puntos de fusión y ebullición. Conducen la electricidad cuando se derriten, y son solubles en agua pero no en líquidos no polares. Uno de los compuestos iónicos más comunes es el cloruro de sodio (NaCl), también conocido como sal de mesa.
Compuestos covalentes
En contraste, los compuestos covalentes típicamente ocurren entre los no metales o dos átomos de los mismos elementos o similares. Los átomos con electronegatividades similares, que se pueden determinar a partir de la tabla periódica, tienden a atraer entre sí y formar enlaces covalentes. En lugar de transferir los electrones de valencia por completo, los átomos comparten los electrones externos para satisfacer la regla del octeto. Los electrones compartidos pueden moverse hacia adelante y hacia atrás entre los átomos unidos. Ningún átomo está ganando o perdiendo un electrón en este tipo de enlace, por lo que no se forman iones. Debido a esto, los átomos en el compuesto no son atraídos a otros átomos cercanos como los que se ven en los compuestos iónicos.
Los compuestos covalentes pueden ser sólidos, líquidos o gases. Tienden a ser malos conductores eléctricos y tienen bajos puntos de fusión y ebullición. Tienden a ser solubles en líquidos no polares pero no en agua. Algunos ejemplos comunes de compuestos covalentes son el metano (CH4) y el dióxido de carbono (CO2).