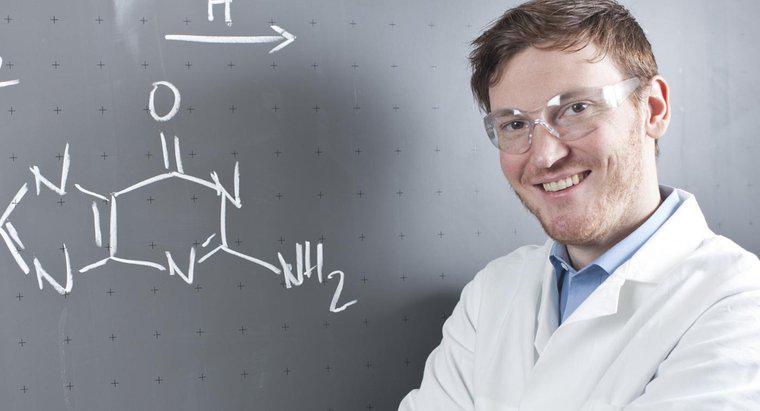
Una flecha que apunta en ambas direcciones en una ecuación química muestra que la reacción es reversible y puede avanzar en ambas direcciones. Esto significa que los reactivos en el lado izquierdo también son productos de los de la derecha y viceversa.
Es incorrecto escribir una reacción reversible como dos ecuaciones químicas separadas (una para cada dirección) porque los productos siempre reaccionan y vuelven a los reactivos originales. Debido a que ambas reacciones ocurren simultáneamente, el sistema químico está en un estado de flujo hasta que se alcanza el equilibrio. Esto significa que hay un punto en el que la concentración de cada reactante permanece constante y no presenta cambios netos a lo largo del tiempo. Sin embargo, esto no significa que todos los reactantes estén presentes en proporciones iguales.
La velocidad de reacción y los coeficientes de reacción de cada reactante determinan qué cantidad de esto se produce y con qué rapidez. Debido a que algunas reacciones son más rápidas y requieren mayores cantidades de un reactivo que otro, no están presentes en cantidades iguales cuando el sistema alcanza el equilibrio. En los sistemas de equilibrio dinámico, las tasas de reacción para ambos lados de la ecuación son exactamente las mismas, por lo que las concentraciones de los reactivos y los productos permanecen constantes, aunque ambas reacciones continúan indefinidamente.