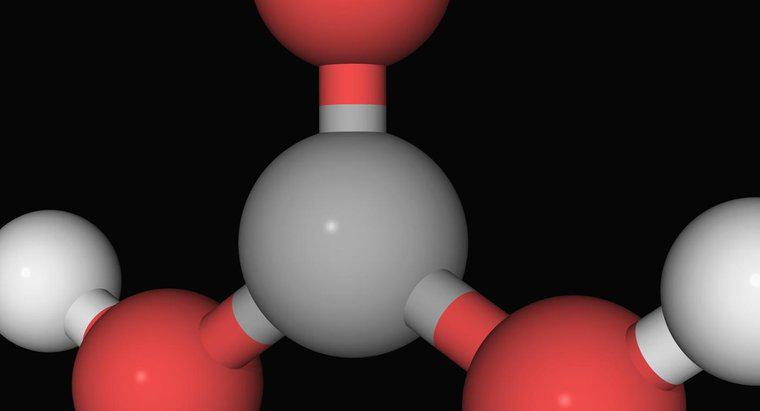
La definición de Arrhenius de un ácido es un compuesto que aumenta el número de iones de hidrógeno cargados positivamente, H +, cuando se agrega al agua. Según Arrhenius, una base es cualquier sustancia que resulta en el aumento de iones de hidróxido cargados negativamente, OH-, cuando se combina con agua.
Estas definiciones fueron desarrolladas en 1884 por Svante Arrhenius, un químico de Suecia.
La definición de Arrhenius de ácidos y bases es una de las dos definiciones aceptadas regularmente. La otra es la definición de Bronsted-Lowry, que describe un ácido como cualquier compuesto que emite protones en una solución acuosa y una base como un compuesto que acepta protones adicionales.