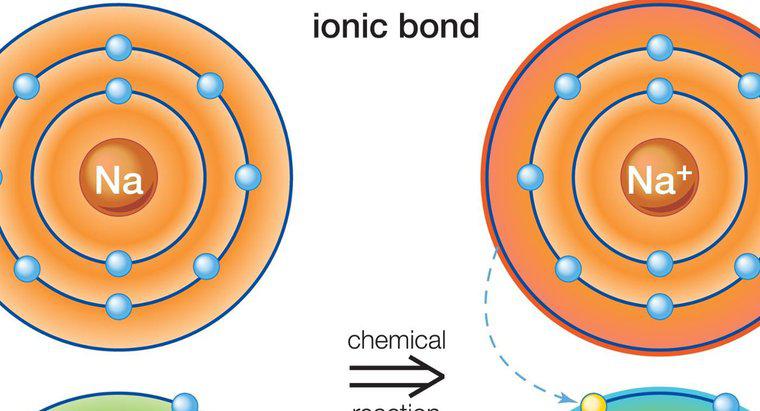
Los átomos más grandes con orbitales de electrones complejos, como los que se encuentran en los metales de transición, pueden superar la regla del octeto en las condiciones correctas. En particular, estos ocurren cuando los elementos más pesados están unidos Elementos pequeños, altamente electronegativos como flúor, cloro u oxígeno. Un ejemplo es el pentacloruro de fósforo, un solo átomo de fósforo unido a cinco átomos de cloro, que tiene 10 electrones compartidos en su capa exterior de valencia.
Cuando un elemento tiene un número atómico suficientemente alto, hay disponible un nuevo tipo de orbital electrónico con capacidad para hasta 10 electrones, lo que permite hasta cinco enlaces simples. Esto es lo que ocurre con el pentacloruro de fósforo. Para hacer uso de ese orbital, sin embargo, la reacción que crea el compuesto que usa este orbital debe ser muy energéticamente favorable. Esta es la razón por la cual, para que funcione, deben participar elementos con una capacidad muy fuerte para atraer y unir electrones, también conocida como electronegatividad. El oxígeno tiene una alta electronegatividad, pero es poco probable que cree un compuesto con cinco átomos unidos como lo hace el cloro, ya que requiere dos electrones para completar su capa exterior de valencia. El flúor y el cloro solo requieren uno, por lo que es más probable este tipo de configuración.