El enlace de hidrógeno implica los cambios de dipolo creados por los enlaces polares y se produce entre las moléculas que contienen enlaces polares. El hidrógeno está involucrado específicamente porque el elemento tiene una baja electronegatividad para un no metal y crea un gran cambio de dipolo que es lo suficientemente fuerte como para atraer a otros átomos electronegativos de enlaces polares en otras moléculas.
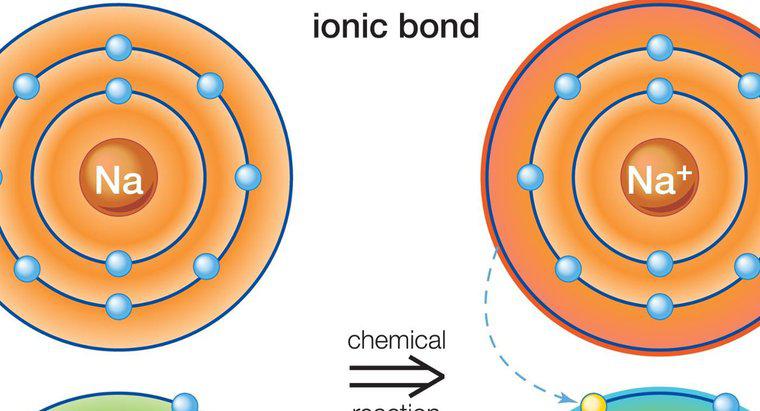
Los enlaces covalentes polares se forman cuando los enlaces de dos átomos tienen una diferencia en la electronegatividad que es lo suficientemente significativa como para crear un cambio en la carga, pero es menor que la diferencia requerida para formar un enlace iónico. En un enlace covalente polar, los átomos comparten los electrones de manera desigual. Esto crea un cambio de dipolo y le da a un extremo una carga ligeramente positiva y al otro una carga ligeramente negativa.
Cuando el hidrógeno está involucrado en un enlace polar, se carga ligeramente positivamente y atrae dipolos cargados negativamente de otras moléculas. La otra molécula no necesita ser polar en general, pero debe tener enlaces polares para formar los dipolos que atraen o repelen las cargas de hidrógeno. El enlace de hidrógeno es una forma más débil de enlace que los enlaces iónicos o covalentes, pero es lo suficientemente significativo como para crear propiedades únicas y fuerzas atractivas, como las que se observan entre las moléculas de agua.