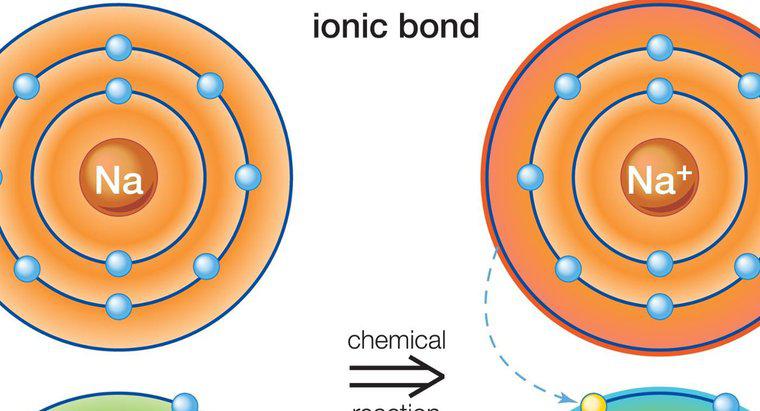
Dado que son el resultado de la atracción entre cargas parciales en lugar de cargas completas, los enlaces de hidrógeno son mucho más débiles que los enlaces iónicos o covalentes. Los enlaces iónicos y covalentes atraen a los átomos de diferentes sustancias para formar Las moléculas de los compuestos, mientras que los enlaces de hidrógeno son fuerzas que tienden a atraer moléculas entre sí. Un ejemplo de enlace de hidrógeno es la atracción entre moléculas de agua individuales, mientras que la atracción entre los átomos de hidrógeno y oxígeno dentro de cada molécula de agua representa un enlace covalente.
Un enlace de hidrógeno se forma cuando un átomo de hidrógeno polarizado positivamente en una molécula es atraído a un átomo altamente electronegativo en otra molécula. En el ejemplo de las moléculas de agua, el átomo de oxígeno cargado negativamente en una molécula de agua atrae al átomo de hidrógeno cargado positivamente en otra molécula de agua. Los átomos de oxígeno tienden a robar electrones de los átomos de hidrógeno dentro de las moléculas. Cuando esto ocurre dentro de una molécula de agua, la pérdida de electrones crea un átomo de hidrógeno con una carga positiva parcial, que luego es atraída por un átomo de oxígeno cargado negativamente en otra molécula de agua.
Los enlaces de hidrógeno que se forman entre las moléculas de agua hacen que se peguen entre sí. Esto le da al agua una temperatura de punto de ebullición alta porque se requiere un mayor grado de energía térmica para romper los enlaces de hidrógeno intermoleculares. Muchas sustancias orgánicas que se requieren para mantener la vida, como los ácidos nucleicos y las proteínas, contienen enlaces de hidrógeno. Aunque estos enlaces son más débiles que los enlaces internos iónicos o covalentes que existen entre los átomos dentro de las moléculas, la fuerza acumulada de los enlaces de hidrógeno dentro de los organismos vivos es altamente significativa y desempeña un papel importante en el mantenimiento de la estabilidad.