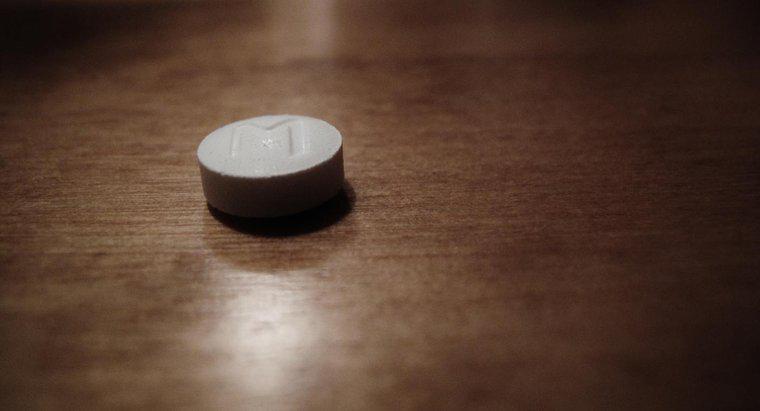
Los químicos escriben la estructura de Lewis del ión hidróxido como HO con un conjunto adicional de 3 pares de electrones que rodean el oxígeno, un par en la posición de las 12 en punto, un segundo par en la posición de las 3 en punto y el último par en la posición de las 6 en punto. El ion completo está rodeado por corchetes con un signo negativo en la parte superior derecha, que representa la carga iónica general.
Las estructuras de Lewis implican elegir el átomo central y escribir su símbolo. Las reglas establecen que debe tener la electronegatividad más baja. La electronegatividad disminuye en la tabla periódica de arriba a abajo y de derecha a izquierda. Otros átomos en el ion o compuesto se conectan con un guión para representar un enlace simple; sin embargo, a veces es necesario cambiar a enlaces dobles o triples para completar la estructura.
Los estudiantes generalmente no dibujan estructuras de Lewis para elementos más allá del período 4 que requieren electrones adicionales para llenar su capa exterior, por lo que pueden usar la regla del octeto. Afirma que con la excepción del hidrógeno y el helio, los átomos con 8 electrones en la capa exterior son estables.
La estructura representa el número de electrones que cada átomo dona como puntos a su alrededor. Algunos átomos no proporcionan suficientes electrones para satisfacer la regla del octeto, lo que requiere enlaces dobles o triples. Cada enlace representa dos electrones.
Una vez que los electrones están en su lugar, el científico dibuja corchetes alrededor de toda la estructura. Un signo en superíndice a la derecha del último corchete representa cualquier carga en un ion.