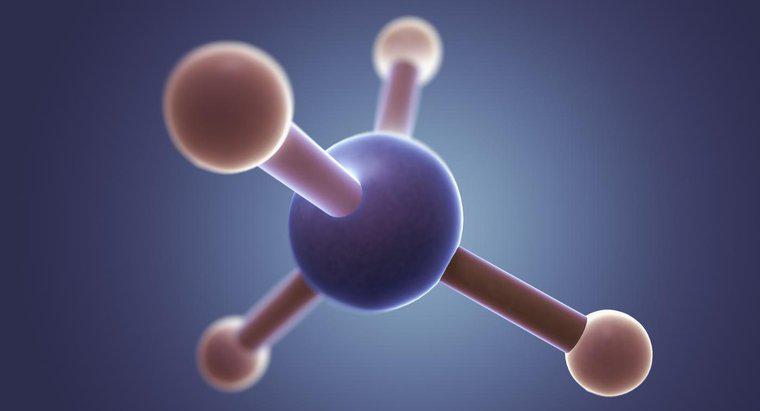
La estructura de puntos de Lewis para CH2F2, la fórmula química para el difluorometano, es una C en el centro con líneas en cada lado hacia las dos H y las dos F. Cada H contiene 3 pares de puntos alrededor de los lados no unidos.
En la estructura de Lewis, la C representa el carbono, la H representa los dos átomos de hidrógeno, la F representa los dos átomos de flúor, los puntos representan los electrones y las líneas representan un par de electrones unidos. Cada átomo de flúor contiene siete electrones de valencia. Este número se puede determinar por la columna de flúor en la tabla periódica. Cada átomo de carbono tiene cuatro electrones, también se muestra por su columna en la tabla periódica. Para unirse con dos átomos de flúor, el átomo de carbono debe crear un enlace único con cada átomo de flúor, utilizando sus electrones de valencia. Uno de los siete electrones de valencia de los átomos de flúor se une con el único electrón del átomo de carbono, dejando a cada átomo de flúor con seis electrones de valencia no unidos restantes. En la estructura de puntos de Lewis, estos electrones restantes están representados por puntos colocados igualmente alrededor del símbolo de los elementos. Para verificar nuevamente la precisión de la estructura de puntos de Lewis, los estudiantes pueden contar todos los electrones, contando cada punto como un electrón y cada enlace como dos electrones. El número de electrones en la estructura debe ser igual al número de electrones en CH2F2.