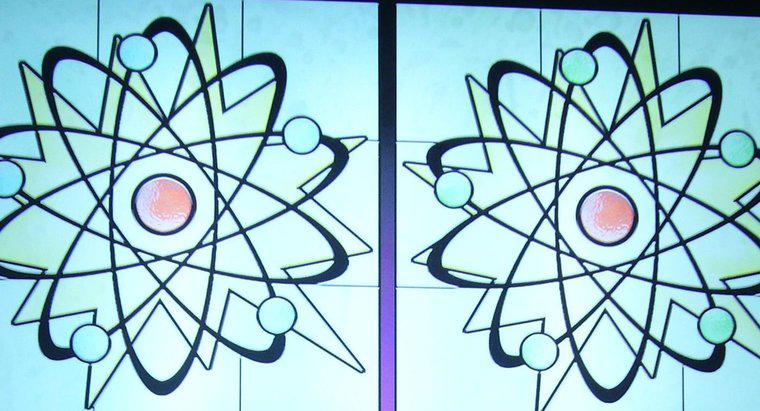
El número atómico de un átomo es el número de protones que residen en el núcleo, mientras que el número de masa es el número de protones y neutrones combinados. El número atómico determina el tipo de elemento de un átomo , mientras que el número de neutrones determina el isótopo del elemento. Muchos elementos ocurren naturalmente en la forma de varios isótopos diferentes.
Todos los átomos tienen un núcleo, compuesto por un grupo de protones y neutrones, así como una "nube" de electrones que rodea el núcleo. Los protones son partículas cargadas positivamente, los neutrones son partículas que no tienen carga y los electrones son partículas que tienen una carga negativa.
En la mayoría de las circunstancias, la carga neta de un átomo es neutral porque los protones y los neutrones se encuentran en cantidades idénticas. Cuando un átomo gana o pierde un electrón, el átomo se convierte en un ion cargado. Si se pierde un electrón, el átomo se carga positivamente; sin embargo, si gana un electrón, el átomo se carga negativamente.
Si un átomo pierde un neutrón y se convierte en un isótopo, sus propiedades pueden diferir de las que se encuentran en la configuración natural. A menudo, los átomos que son radiactivos experimentan un proceso de descomposición que hace que el átomo pierda sus neutrones.