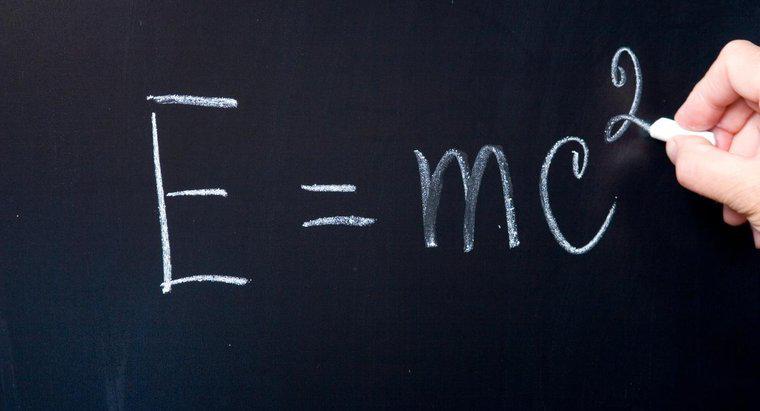El "nivel de energía ocupado más alto" significa el nivel de energía en el que residen los electrones de valencia. Los elementos siguen la regla del octeto, lo que significa que desean alcanzar la disposición estable de tener ocho electrones en su nivel más alto ocupado nivel de energía. Algunos átomos quieren abandonar los electrones, y otros quieren ganar electrones para volverse más estables.
Los electrones de valencia solo existen en los orbitales s y p del nivel de energía más alto. El principio de Aufbau establece que los electrones deben llenar los niveles de energía más bajos primero antes de pasar al siguiente nivel de energía. Cada nivel de energía tiene un número específico de orbitales; solo dos electrones que giran en direcciones opuestas pueden llenar cada orbital. Los electrones existen a diferentes distancias del núcleo del átomo. Los electrones que ocupan orbitales más cercanos al núcleo tienen menor energía que los que orbitan más lejos.
Los elementos más estables de la tabla periódica, los gases nobles, tienen ocho electrones en su nivel más alto de energía ocupada; Los gases nobles no forman fácilmente compuestos con otros elementos. Los electrones en el nivel más alto de energía ocupada tienen mucho que ver con la reactividad del elemento. Elementos como los metales con pocos electrones en sus niveles más altos de energía quieren donarlos a otros elementos. Los elementos como los no metales tienen casi un complemento completo de ocho electrones en sus niveles de energía más externos, por lo que quieren obtener electrones de los elementos.