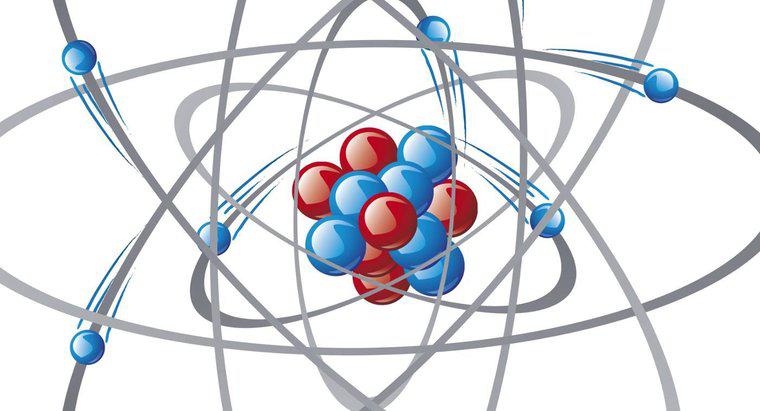
Los cationes son iones cargados positivamente y los aniones son iones cargados negativamente. Los metales actúan como cationes y voluntariamente dan o donan electrones a no metales. Los no metales actúan como aniones y aceptan electrones donados. Los átomos son más estables cuando su capa más externa contiene ocho electrones. Para lograr esto, los metales y los no metales reaccionan entre sí y forman enlaces iónicos. Esta atracción positiva y negativa es lo que crea compuestos iónicos, explica Dummies.com
Por cada electrón que un catión dona, recibe una carga positiva, o 1+. Por cada electrón que un anión acepta, recibe una carga negativa o 1. La cantidad de electrones que un átomo está dispuesto a donar o aceptar a menudo se puede determinar por la posición del elemento en la tabla periódica. El grupo 1A contiene metales alcalinos, que donan un solo electrón para una carga de 1+. Los metales alcalinotérreos en el grupo 2A pierden dos electrones para una carga 2+. El aluminio pierde tres electrones por una carga de 3+. Los metales de transición, o miembros de la familia B de la tabla periódica, pueden ser más difíciles de determinar. Muchos de estos elementos pueden perder un número variable de electrones, por lo que pueden formar dos o más variantes de cationes.
El número de electrones que un no-metal, o anión, está dispuesto a aceptar depende de su número de electrones de valencia. Los electrones de valencia son aquellos en la capa más externa del átomo, y los átomos son más estables con un total de ocho electrones de valencia. Para lograrlo, aceptan el electrón donado de cationes. Los halógenos en el grupo 7A de la tabla periódica tienen siete electrones de valencia. Aceptan un electrón por 1 carga. Los aniones del grupo 6A aceptan dos electrones para una carga de 2. Los elementos del grupo 5A aceptan tres electrones para una carga de 3. Los elementos del Grupo 8A son gases nobles y ya tienen carcasas de electrones de cenefa completa y, por lo tanto, no son reactivos.