Los compuestos iónicos conducen la electricidad cuando se disuelven en agua porque el movimiento de sus partículas cargadas negativamente y cargadas positivamente forma una corriente eléctrica, explica About.com. En este estado líquido, los iones cargados se separan y muévete libremente, creando una corriente de partículas eléctricas que conducen la electricidad.
La conductividad eléctrica mide la capacidad de una sustancia para producir una corriente eléctrica, mientras que la electricidad es el movimiento de partículas cargadas que forman esa corriente eléctrica. Una corriente, en el ámbito eléctrico, es simplemente un flujo de cargas que requiere libre movimiento. Para que se forme la corriente eléctrica, tanto el movimiento como la conductividad deben estar presentes.
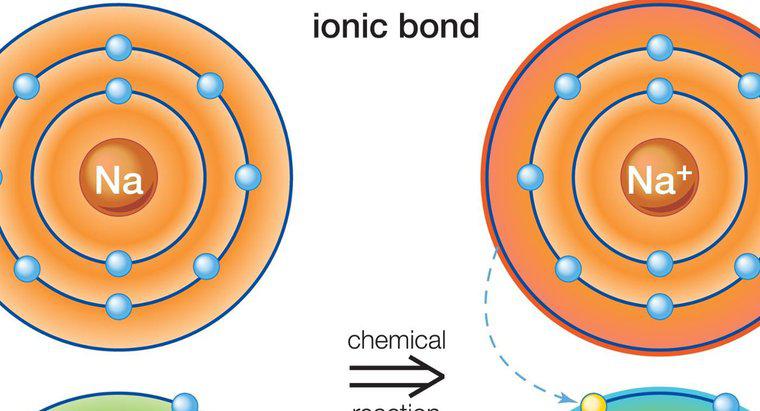
Los compuestos iónicos se forman cuando los iones cargados positiva y negativamente se unen estrechamente. Estos iones son átomos que han ganado o perdido un electrón, y se unen mediante la transferencia de un electrón en un proceso llamado enlace iónico. Un ion cargado positivamente es un catión, mientras que un ion cargado negativamente es un anión. Un ejemplo de un compuesto iónico es el cloruro de sodio, NaCl, en el que el sodio (NA) es el catión y el cloro (Cl) es el anión. Los compuestos iónicos en su estado sólido tienen partículas que se mantienen unidas entre sí, lo que restringe todo movimiento y evita que se forme una corriente eléctrica. En consecuencia, los sólidos iónicos no conducen la electricidad. Cuando se disuelve en agua, el enlace iónico se rompe, lo que permite que los iones cargados se separen y fluyan libremente. El agua proporciona el movimiento de las partículas y los iones separados proporcionan la conductividad. Dado que ambos están presentes, se crea una corriente eléctrica para conducir la electricidad.