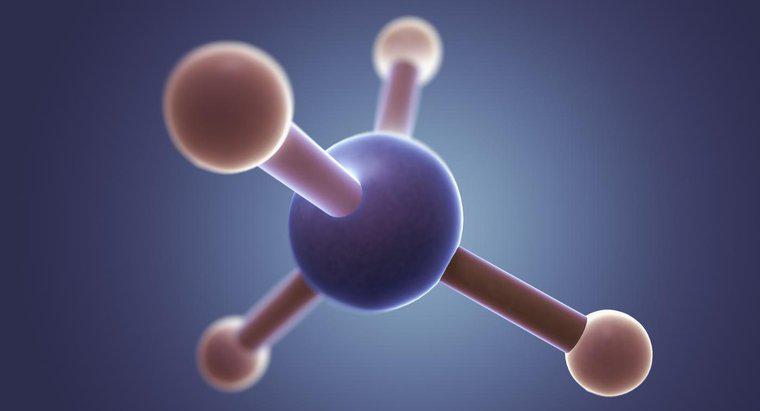
El cloruro de metilo (CH3Cl) tiene una forma tetraédrica con un ángulo de unión de 109.5 grados. Esto se debe a que el carbono tiene cuatro electrones de valencia que forman cuatro enlaces y en un espacio tridimensional, una forma tetraédrica permite que los electrones unidos estén más alejados entre sí.
Las formas moleculares se predicen utilizando la teoría de la repulsión de pares de electrones de valencia (VSEPR). De acuerdo con VSEPR, las moléculas tendrán una forma geométrica que les permita a sus centros de carga negativa (electrones unidos por un solo par) estar tan alejados entre sí como sea posible, debido a la repulsión mutua de las cargas negativas. Las moléculas con dos centros negativos tienden a ser lineales (un ángulo de unión de 180 grados en un plano bidimensional). Las moléculas con tres centros negativos son trigonal planar (ángulos de enlace de 120 grados en un plano bidimensional), y las moléculas con cuatro centros negativos son tetraédricas (ángulos de enlace de 108.5 grados en un espacio tridimensional).
El cloruro de metilo tiene un átomo de carbono central rodeado por cuatro enlaces simples (tres a hidrógeno y uno a cloro). Por lo tanto, según VSEPR, la molécula tendrá una forma tetraédrica con un ángulo de enlace de 108.5 grados para permitir la máxima separación de los electrones unidos.