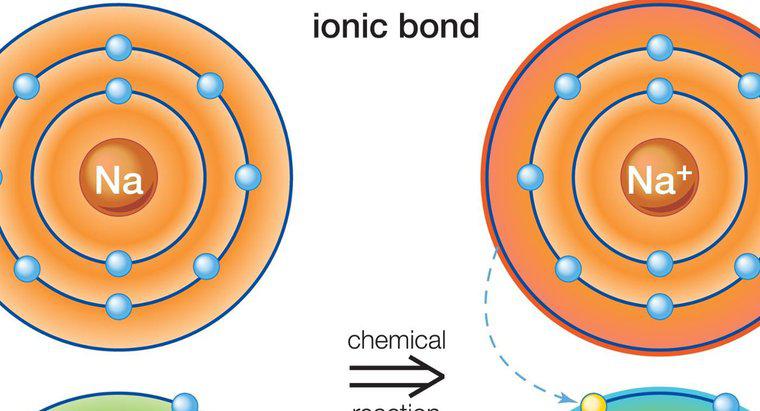
Un enlace iónico es un tipo de enlace químico establecido entre dos átomos por la transferencia de electrones de valencia de un átomo a otro. Este tipo de enlace también se conoce como enlace electrovalente o polar. Las sales son un buen ejemplo de sustancias hechas con enlace iónico.
Un enlace iónico involucra un metal y un átomo no metálico. Cada átomo tiene una tendencia a lograr la configuración electrónica estable, lo que significa lograr el número de octeto (2 u 8) para su cáscara de cenefa. El átomo de metal tiene un exceso de electrones por encima del número de octeto en su cáscara de cenefa. Por otro lado, el átomo no metálico carece de electrones y, por lo tanto, necesita electrones para cumplir su octeto. Una vez que se encuentran entre sí, el átomo de metal entrega sus electrones excedentes al átomo no metálico. Como resultado de esta transferencia de electrones, cada uno de los átomos alcanza la configuración electrónica estable. El compuesto está formado por este enlace llamado compuesto iónico o electrovalente. En los enlaces iónicos, la carga neta del compuesto debe ser cero. Algunos ejemplos de compuestos iónicos son: NaCl (cloruro de sodio), MgO (óxido de magnesio), CaF2 (fluoruro de calcio) y Al2O2 (óxido de aluminio). En el mundo real, no se sabe que existan compuestos con enlace iónico puro. Todos los compuestos iónicos tienen un grado de enlace covalente.