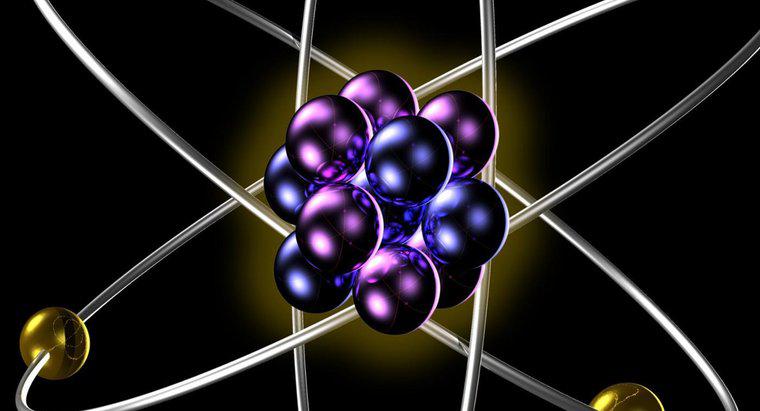
Los isótopos del mismo elemento tienen el mismo número de protones y electrones cuando están en forma atómica neutra. Los diferentes isótopos tienen diferentes números de neutrones en sus núcleos, lo que resulta en diferentes pesos atómicos para los diferentes isótopos de un solo elemento.
El número de protones en el núcleo de los átomos de un elemento da la masa atómica de este elemento. La masa atómica es constante para todos los isótopos del elemento. Debido a que la masa atómica determina el número de electrones que deben orbitar el núcleo para que el átomo sea neutral, esta masa atómica determina el comportamiento químico del elemento, ya que toda la química no nuclear resulta de las interacciones de las nubes de electrones de los átomos con uno otro. Esto significa que todos los isótopos del mismo elemento participan de la misma manera en las reacciones químicas.
Una diferencia en el comportamiento de los isótopos surge cuando los núcleos de ciertos isótopos son inestables debido a un desequilibrio en el número de protones a neutrones en el núcleo. Debe haber aproximadamente un neutrón para cada protón para que un núcleo atómico sea estable. A medida que el número de neutrones aumenta desproporcionadamente al número de protones, el núcleo se vuelve inestable, eliminando este exceso de peso de neutrones en forma de partículas alfa y beta y radiación gamma.