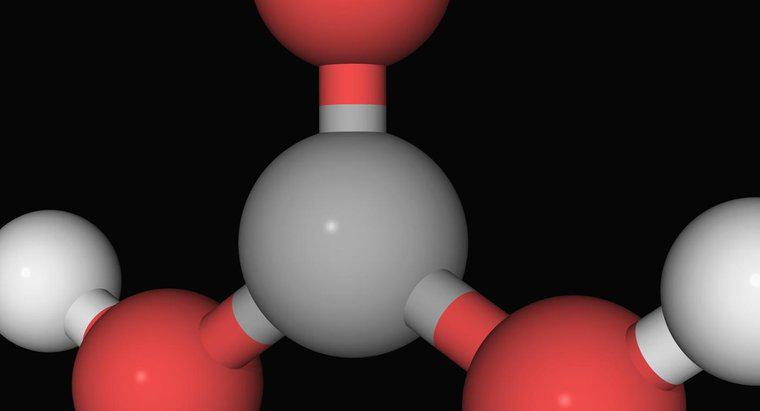
El amoniaco, un compuesto gaseoso de un átomo de nitrógeno unido a tres átomos de hidrógeno, no es una base fuerte. Es una base más débil que generalmente debe reaccionar con el agua antes de reaccionar con un ácido. Antes de que neutralice los ácidos en una solución, reacciona con el agua para formar iones de amonio e hidróxido. El amonio es un ion positivo de un nitrógeno y cuatro átomos de hidrógeno, y es un ácido débil.
Todas las bases funcionan aceptando iones de hidrógeno, que son solo protones desnudos. Esto neutraliza los ácidos, ya que los ácidos actúan liberando iones de hidrógeno para reaccionar con otros materiales. Las bases reaccionan con estos iones más poderosamente que otros materiales, y por lo tanto pueden proteger estos otros materiales de los ácidos. Sin embargo, las propias bases pueden ser corrosivas.
Las bases más fuertes, como el hidróxido de sodio, funcionan al disociar sus iones de hidróxido en solución. Los iones hidróxido reaccionan muy fuertemente con los iones de hidrógeno para formar agua. Los otros componentes de los ácidos y bases a menudo se asocian como sales. Sin embargo, el amoniaco no contiene iones hidróxido. Primero debe reaccionar con el agua para generarlos. Esto no solo agrega un paso antes de neutralizar los ácidos, sino que se contrarresta parcialmente con la creación de amonio, un ácido más débil.